抗癌新藥公司台睿生技今年將啟動TRX 818 的美國一期臨床,TRX 818 為多標靶抗癌藥,具備高度創新性, 其團隊部分成員曾成功開發全球首個標靶藥物Nexavar( 原廠Bayer)。台睿在台灣再造Nexavar 的成功經驗, 並計畫2015 年登錄興櫃,2017 年啟動IPO。

台睿生技總經理簡督憲 (左) 與醫睿醫藥總經理朱伊文(右) (圖 / 林嘉慶)
全球百大暢銷藥物中,超過三分之一都是標靶藥物。 標靶藥物多以治療癌症及免疫疾病為主,顧名思義即專一作用在疾病生成相關的“標 靶”來抑制疾病發生。
這些「標靶」包括與疾病或腫瘤相關的接受體、基因或訊息傳遞路徑,或腫瘤之血管新生因子等。由於標靶藥物作用在特殊位置,相較於傳統化學藥物對正常細胞的影響較小, 也比較不會現一般常見的嚴重副作用如噁心嘔吐、血球抑制或掉髮等。
不過,目前標靶藥物多作用在單一靶點上,但特別是癌症、慢性病或退化性疾病都是多重致病成因;且多注射劑型,許多病患也出現嚴重抗藥性。 新一代的標靶藥物- 口服、更安全有效、多標靶作用的新藥(Multiple Targeted Drug)開發也脫穎而出,並吸引大藥廠和生技公司投入, 也成了新世代標靶藥物的開發趨勢之一。
神槍手(sharpshooter)抗癌藥物
歐美研究人員把這種新一代的多標靶藥物比喻為「神槍手(sharpshooter)」。以抗癌藥物為例,能夠同時抑制某些種類的癌症腫瘤形成, 諸如乳腺癌和肝癌,以及大腸癌和腦癌腫瘤;或具備可同時抑制腫瘤分生細胞、腫瘤細胞自身凋亡和抑制血管增生等治療效果。
現在,台灣也有一個「神槍手」。
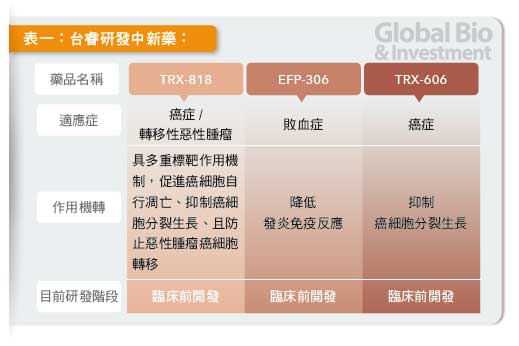
由原料藥廠台耀(4746) 及醫睿( 晟德(4123) 持股16%) 共同於2011 年9 月成立的台睿生技,其研發開發的多標靶乳癌治療新藥-TRX 818, 今年將啟動美國一期臨床實驗,成為台灣多標靶藥開發並成功進入臨床的先驅。
台睿目前股本3.74 億元,目前主要股東包括除醫睿25%、泛台耀約15%外,還包括台工銀(IBT)17.8%、國發基金5.35% 等。
由於其團隊部分成員曾有過開發全球第一個標靶藥物Nexavar( 原廠Bayer) 的成功經驗,TRX 818 順利的話今年可望完成一期臨床, 加上現有Pipeline產品中兩項原料藥劑型改良藥物,口服紫杉醇抗癌藥TRX 606 及抗敗血症用藥TRX306,只要進行銜接性實驗(BSE), 可直接進行三期臨床。
創立不到3年,但經營團隊有來頭,公司很快就切入最創新的抗癌藥領域,並找到讓公司能快速有業績貢獻的模式。 因此,當台睿一傳出規劃2015 年登錄興櫃,並計畫於2017 年啟動IPO 前增資5 億台幣,立即引起創投業不少矚目。
Nexavar 標靶藥物開發團隊班底
現任台睿生技總經理同時是醫睿醫藥董事長簡督憲,2002 年受到台灣生技興起感召回台前,正是Bayer標靶藥物開發部門的核心成員之一。 畢業於台北醫學院藥學系,1986 年獲得愛荷華大學藥學系((UIP) 的生物製藥學(Biopharmaceutics) 及藥物動力學(Pharmacokinetics)博士學位, 簡督憲出自聞名美國藥界的劑型改良學研單位,也以劑型設計躋身Bayer 新藥開發技術團隊中不可或缺的角色。
何謂「銜接性試驗」
為可提供與國人相關之藥動/ 藥效學或療效、安全、用法用量等臨床試驗數據,使國外臨床試驗數據能外推至本國相關族群之試驗, 減少臨床試驗重複執行,以避免研發資源之浪費。
98 年02 月13 日衛署藥字第0980303366 號令( 主旨: 修正「藥品查驗登記審查準則」第二十二條之一) 之內容,目前已明訂新成分新藥須於其查驗登記申請案前或 與查驗登記申請案同時申請銜接性試驗評估。
簡督憲後來更全程參與了標靶藥物Nexavar 的開發,在開發小組中負責劑型研發。一直到2012 年,美國專利商標局(USPTO) 核發了第二代Nexavar 標靶藥物的劑型發明專利, 儘管專利所有權歸屬Bayer 原廠,但專利發明人的榮耀及牌證,仍還於人已經在台落地生根的簡督憲。

第二代Nexavar 標靶藥物的劑型發明專利,發明人即是已回台落地生根的簡督憲。( 圖/ 資料中心)
Nexavar 是全球首個成功開發的標靶藥物,藥物屬全新機制用藥,但美國FDA 甚至破例讓該藥以「孤兒藥」方式核准於臨床二期完成即上市。 總計Nexavar 從動物實驗到二期臨床只花了五年的時間,適應症為治療末期腎癌,之後第七年再取得肝癌的新適應症。 簡督憲也在這次任務和經歷中,結交了今日台睿生技藥物開發的夢幻團隊班底,奠定了台睿於台灣新藥開發業的競爭力,也被看好在藥物開發上可達到較佳的開發效率。
當時同事、目前擔任台睿毒理病理顧問的Harry Olson,後來曾任輝瑞藥廠副總,是FDA 毒理顧問,他有多次發現垂死藥物新作用的戰績, 現在坊間最流行的綜合維他命食品「善存」就是他的傑作。
另一位同事Nancy C.Motola 則現任台睿法規顧問,擁有30 年經驗與FDA 新藥法規互動的實務經驗; 另有其他兩位外籍法規顧問Wendy Rey 和Quintile Avntis 則分負責台睿劑型規範以及歐洲藥物生產流程法規。
目前全心投入負責台睿臨床醫學的Hyler Friedman, 則是美國Adaptive clinical trial(適應性臨床試驗)法規發起人之一, 也曾任輝瑞藥廠的副總,以調整臨床設計的聞名,擅長一邊進行臨床一邊改良藥物,能有效縮短藥物臨床時程。
而現任醫睿醫藥總經理的朱伊文博士,則曾於國衛院擔任研究員多年,是台灣專注腫瘤移轉研究的專家。
口服TRX 818 可抗脈管增生
也正因這樣的團隊背景,台睿的全新多標靶抗癌新藥TRX818 深受期待。
簡督憲說,TRX818 最早是2009年醫睿醫藥從前中國醫學大學校長郭盛助和台大、 美國北卡羅來納大學(North Carolina State University) 共同研究的成果技轉而來。
當時, 簡督憲從順天生技離開後, 自行創業成立醫睿醫藥(EffPha),並取得由台灣東洋所主導之晟德的資金投資, 稱得上是台灣第一家新藥設計開發專案承攬服務公司。
醫睿針對新藥本身進行評估,包括藥理、毒理,開發成本、法規狀況,與所涉及的專利權問題, 以及未來競爭力等做出專業評估。到最後上市後,再按協議比例獲取權利,「其營運模式類似今天的超級育成中心(SIC),」簡督憲表示。
簡督憲說,郭盛助是台灣的化學合成權威,團隊評估後,初步發現該藥物初步可達到四種癌症增生途徑的同步阻絕, 並可採口服,且毒性低,還能與現有抗血管增生用藥( 如Avastin) 合併使用,是一個絕佳的多標靶藥物開發標的。
憑藉多年新藥評估與設計的經驗,團隊極看好這項新藥的開發,為了能獨立合成及生產該藥物,簡督憲隨後引進原料藥製造公司—台耀化學成為策略夥伴。
簡督憲表示,已知癌細胞的生成有四種途徑,包括荷癌細胞增生、癌細胞快速分裂、癌細胞無法自然凋亡、以及細胞內血管增生。 目前單標靶治療方法,主要是堵住其中一至兩項的癌細胞增生途徑,其中阻止訊息傳遞抑細胞增生的標靶藥物是目前主流,近年,也有不少抗血管增生的藥物問世。
不過,最新研究發現,即使採用抗血管增生的標靶藥物,仍有不少病患產生抗藥性, 主要原因在於部分癌細胞血管增生並直接由脈管增生成血管,而且越是惡性腫瘤的發生比率越高。
TRX 818 初步證實可抗脈管增生,具有獨特之抑制腫瘤細胞自行形成血管壁的活性, 於多種癌症腫瘤包括肝癌、腦癌、乳癌、直腸癌等皆有良好抗癌效果,因此,具有全球新型抗癌藥獨特創新的競爭優勢。
TRX 818 已經歸化今年先送美國進行一期臨床試驗,初個適應症鎖定乳癌;後續也規劃也比照Nexavar經驗, 望在包括台灣在內的亞洲進行肝癌、直腸癌的臨床試驗。
TRX 606、TRX306 明年進入三期臨床
除了全新抗癌標靶用藥TRX818 外,台睿目前還有二項新藥,一個是以治療癌症為主的TRX 606,為舊藥新劑型的口服紫杉醇癌藥; 一個是敗血症之輔助治療用藥TRX306。兩者皆屬於505(b)2 類之新藥,亦即只要進行銜接性實驗,即可進入三期臨床試驗。
TRX 606 配方為食用級配方,安全性無慮,預計2015 年即可進入三期臨床試驗,預估2017 年台灣、中國及韓國的市場潛力約25 億美元。 TRX306 是台灣急診室醫師建議開發之藥物,歐洲已有上市的類似藥,可降低42%死亡率,由於安全性已獲驗證,市場潛力估計將達17億台幣。
台睿雖然創立不到3 年,但挾著團隊曾打造全球首個標靶藥物- 拜耳藥廠的蕾莎瓦(Nexavar) 經驗,除致力於開發新一代的抗癌藥物新藥外, 也搭配低風險劑型改良新藥的經營模式,讓公司能快速創造業績貢獻,業界更高度專注台睿是否能再創過去的成功經驗。
..本文節錄自環球生技月刊2014. 4月號





發表迴響
抱歉,你必須要登入才能發表迴響喔!